Impacto de la fiebre Q sobre la microbiota ovina y caprina y sus implicaciones reproductivas
Raquel Toledo
Investigadora del Grupo ProVaginBIO de la Universidad CEU Cardenal Herrera de Valencia
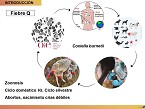
27/10/2025La fiebre Q es una enfermedad zoonótica de origen bacteriano, en concreto de la bacteria Coxiella burnetii, y es de declaración obligatoria. Hemos realizado una serie de investigaciones sobre el impacto en la microbiota y las implicaciones reproductivas en pequeños rumiantes.

Dentro del ciclo epidemiológico de la fiebre Q, tenemos un ciclo que se denomina silvestre, donde se encuentra la implicación de diferentes ungulados, mamíferos y aves; y el ciclo doméstico, focalizándonos en los pequeños rumiantes, a los que siempre se les ha acusado de ser el principal reservorio y fuente de transmisión de fiebre Q para los humanos. La clínica principalmente es abortiva a término de gestación, así como el nacimiento de crías débiles al parto y otros problemas reproductivos en estas especies.
El brote zoonótico de origen caprino más importante hasta el momento fue el que se aconteció en Países Bajos en el año 2007, con el sacrificio casi completo de la cabaña ganadera caprina en este país. La notificación de casos de fiebre Q va en auge en Europa y España es el país que más casos de fiebre Q notifica en humana, con una amplia variabilidad por comunidades autónomas.
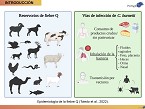
A nivel de rebaño, los laboratorios privados reportan esta zoonosis como una de las principales zoonosis abortivas diagnosticadas en los rebaños ovinos y caprinos. Por tanto, esto tiene una serie de implicaciones ya no solo sanitarias, sino también económicas en los rebaños. La transmisión principal de Coxiella burnetii se produce por la inhalación de la bacteria a partir de diferentes vías. Además, la EFSA también ha descrito otras vías de transmisión menos frecuente a humanos, que sería el consumo de productos crudos o sin pasteurizar, o bien la transmisión por vectores, en este caso de mayor importancia en el ciclo silvestre de la enfermedad, que es el caso de las garrapatas. La bibliografía contempla la vía vaginal, fecal y láctea de las principales identificadas para la excreción de Coxiella burnetii en rumiantes domésticos en general.
Respecto a las medidas de control, la vacunación es la principal herramienta de lucha frente a la enfermedad, pero quedan aspectos como cuánto tiempo se debe seguir vacunando o a quién se vacuna en un rebaño y qué pasa con los machos.
Por otro lado, la clínica respiratoria, sobre todo las neumonías en humana, son la principal clínica reportada, pero en rumiantes domésticos existe un tropismo respiratorio, que no está descrito hasta el momento, a pesar de que la infección también en animales es principalmente la inhalatoria.
Y finalmente esta ponencia tratará de una nueva técnica que no se ha empleado hasta el momento para el estudio de la fiebre Q ni en pequeños rumiantes ni en ninguna especie, que es el uso de la metagenómica como herramienta diagnóstica.

Introducción del estudio
En este estudio no se valora dinámica de excreción en la vacunación ni seroconversión tras la vacunación. Lo único es saber qué pasa tras un brote clínico de la enfermedad.
Las hipótesis para realizar este estudio son, en primer lugar, las medidas de control y prevención frente a Coxiella burnetii y que deberían implementarse en todo el rebaño, independientemente de sexo, edad, clínica… Podría haber un posible tropismo respiratorio infravalorado hasta el momento. Y, finalmente, C. burnetii podría tener un impacto sobre la microbiota de animales infectados por fiebre Q.
Por tanto, el objetivo del estudio fue evaluar la presencia de Coxiella burnetii en rebaños ovinos y caprinos ubicados en el este de la península ibérica, donde circula el patógeno, así como estudiar su microbiota vinculada.
Material y métodos
Se seleccionaron tres rebaños, de los que uno era de caprino lechero y los otros dos eran ovinos, en concreto de ovino lechero y ovino de carne semi-extensivo. Se buscaban rebaños donde nunca se hubiera implementado la vacunación frente a fiebre Q, para partir de un nivel similar. Además, en estos rebaños ya se contaba previamente al inicio del estudio con una confirmación del laboratorio de que al menos C. burnetii estaba circulando en la explotación, ya bien sea por serología o por diagnóstico basado en PCR vaginal o de fetos y placentas.
Estos rebaños tenían también una serie de diferencias epidemiológicas en cuanto a la clínica que habíamos observado en la explotación. En el caso del rebaño caprino, se observó que durante esa paridera donde tomamos las muestras se reportó una tasa de abortos del 70%, que es lo que se considera como una tasa de abortos severa. Además de los abortos, en esta explotación también se observó la muerte de animales adultos, ya a término de gestación, y también observamos el nacimiento de crías débiles, al parto, que terminaban muriendo por no ser encalostrados. Por su parte, el rebaño ovino lechero contaba con una tasa de abortos del 40%, mientras que en el rebaño de carne la tasa de abortos reportada fue del 10%. En ninguno de los dos rebaños de ovinos se reportaron otra sintomatología o clínica compatible con fiebre Q.
De estos animales, se seleccionaron entre 10 y 12 animales de cada explotación, seleccionando dos machos de cada uno de los rebaños y las hembras se dividieron en dos grupos en función de si habían abortado o habían tenido un parto viable o normal. Tanto de hembras como de machos se obtuvieron muestras genitales, como vagina, prepucio, muestras de la nasofaringe, heces, leche y muestras ambientales para el análisis molecular por PCR y metagenómica. Además, se realizó también un estudio de seropositividad donde se obtuvieron muestras de sangre para ver cuál era el estado de estos animales y la sangre también se utilizó para realizar el estudio de la microbiota sanguínea.

Resultados serológicos y de PCR
Los resultados serológicos y de PCR de cada uno de los animales en los diferentes rebaños indican, tras el análisis estadístico, que no había diferencias significativas entre las hembras que habían abortado y las hembras con un parto normal en términos de seropositividad y detección del patógeno Coxiella burnetii en cualquier de las vías estudiadas. Por tanto, este hecho evidencia, verifica y corrobora una de las hipótesis, que es la importancia de incluir a todos los animales del rebaño en las pautas de control t bioseguridad frente a fiebre Q en los rebaños ovinos y caprinos. En el caso del rebaño caprino, que tenía un brote severo con un 70% de tasa de abortos, se observa que el 100% de los animales era seropositivo, incluyendo machos y hembras, y además el 100% de las hembras excretaban por alguna de las vías estudiadas, principalmente la vía nasal y vaginal. También se detectó el patógeno a nivel nasofaríngeo, lo que representa la primera descripción y la primera evidencia científica de presencia de Coxiella burnetii en las fosas nasales de caprinos tras un brote clínico de la enfermedad, mostrando una elevada sensibilidad diagnóstica comparable a la muestra vaginal. Por tanto, evidencia y revaloriza la hipótesis del posible papel infravalorado a nivel respiratorio que tiene la enfermedad. De hecho, esta explotación se siguió monitorizando y en un animal se detectó simultáneamente la presencia de Coxiella burnetii a nivel nasal, a nivel respiratorio de las fosas nasales, nasofaringe y en tejido pulmonar. Por tanto, son necesarios más estudios, pero podría haber un papel infravalorado del sistema respiratorio.
Pasando a los rebaños ovinos, la seropositividad varió en función de cada uno de ellos. El rebaño de ovino lechero, que tenía una tasa de abortos del 40%, mostró una seropositividad del 80% frente al rebaño ovino mixto de carne, donde la seropositividad fue del 50%. En las muestras analizadas por PCR, únicamente en el rebaño lechero se detectaron muestras positivas a nivel bajo, en tres de las ovejas analizadas independientemente abortadas o no abortadas. Por lo tanto, únicamente un diagnóstico serológico podría no reflejar la realidad epidemiológica de un brote clínico de la enfermedad en los rebaños ovinos y caprinos. Por tanto, ello remarca la necesidad de combinar diferentes técnicas diagnósticas, como en este caso sería la PCR. En brotes clínicos no muy severos, podría ser necesario incluso aumentar el número de muestras para llegar a conocer un diagnóstico más fiable.
Los machos tienen importancia a la hora de mantener, perpetuar y distribuir la infección dentro de los rebaños ovinos y caprinos. Ya ha sido reportada la detección de Coxiella burnetii a nivel de prepucio en moruecos. Es verdad que por el momento no podemos hablar de una infección en los machos, pero sí lo que podemos decir es que pueden actuar como portadores de la enfermedad y distribuirla en los rebaños. En las explotaciones de monta natural, sería un riesgo a tener en cuenta. Por tanto, deben incorporarse a las medidas de control y prevención en los planes frente a fiebre Q.
Se tomaron muestras ambientales de los tres rebaños. Se tomaron muestras de las camas de paridera y, como era de esperar, en los dos rebaños con más tasas de abortos y en los únicos donde se había detectado el patógeno en muestras de las hembras, en ambas se detectó el patógeno en las camas. Además, como novedoso de este estudio, se confirmó a los comederos como posible riesgo de transmisión del patógeno. Se detectó en el rebaño caprino ADN de la bacteria en los comederos, por lo que podría actuar como fuente de transmisión entre animales, favoreciendo el contagio directo entre ellos. Prácticamente el 90% de las cabras presentaban muestras positivas a nivel de la nasofaringe. Por tanto, las secreciones nasales podrían contaminar el comedero y favorecer esta transmisión entre los animales de la explotación. En el último rebaño, en el de ovino de carne, con el 10% de abortos, no se detectó el patógeno ni en los animales ni en muestras ambientales. También se tomaron muestras de animales domésticos, de heces principalmente de gallinas y de aves, por la cercanía que tenían con las ovejas. Ninguna de las muestras fue positiva, pero en otros estudios, en brotes clínicos más severos de la enfermedad, sobre todo en el caso del caprino, sí se obtuvieron muestras positivas tanto de perros como de aves. Por tanto, no olvidarnos del papel que pueden tener estos animales domésticos en la transmisión de la enfermedad.

Resultados metagenómicos
Para comprobar la influencia que tenía en la microbiota de los animales, se empleó la metagenómica, que es una técnica molecular que analiza, por ejemplo, de una muestra fecal, qué conjunto microbiano se tiene en esa muestra. Es decir, esta técnica analiza el ADN presente de la muestra y se queda con un fragmento, el 16S, que es como la huella dactilar de cada bacteria. Además, la metagenómica tiene una serie de ventajas que permite evaluar a lo largo del tiempo estos cambios en la dinámica de las comunidades bacterianas.
Los estudios metagenómicos dan resultados tanto de un estudio de diversidad como estudio taxonómico, ya que describe cuántos tipos diferentes de bacterias encontramos en la muestra y cómo se distribuyen entre ellos, cómo es la estructura microbiana de esa comunidad, que en este caso son hembras abortadas y hembras con un parto normal. Además, el estudio taxonómico dice el grupo biológico de las bacgterias y su abundancia.
Por tanto, los primeros resultados metagenómicos en términos de diversidad de los rebaños ovinos indican que se detectaron estas diferencias en función del grupo de hembras abortadas y no abortadas. A nivel fecal y de leche, en el rebaño lechero había diferencias significativas entre las hembras abortadas y no abortadas, evidenciando que la microbiota fecal y la láctea de las hembras con un parto normal era más uniforme y no había ninguna diferencia en la dominancia de algún taxón bacteriano. Y en el caso del ovino de carne, en las hembras abortadas la muestra fecal era más homogénea, y, por el contrario, en la microbiota sanguínea, presentaba una mayor riqueza microbiana en el caso de las hembras con parto normal. En el caso del caprino, esta diferencia no se observó en ninguna de las regiones anatómicas estudiadas. Por tanto, ello se vincula a la siguiente conclusión: un brote clínico severo de la enfermedad tiene un impacto sobre la microbiota global. También se vio reflejado en el número de comunidades bacterianas, donde en las muestras caprinas era mucho menor que en comparación a las muestras ovinas.
Todos los resultados representan el primer reporte científico, que evidencia que tras un aborto, en este caso producido por fiebre Q, hay un impacto sobre la microbiota vaginal.
En el caso del estudio taxonómico, se obtuvo la primera descripción de la microbiota de un animal en diferentes localizaciones anatómicas. A nivel de sangre, se detectaron como principales géneros Estafilococos, Pseudomonas, Micoplasma o Anaplasma. A nivel fecal y nivel nasal, están Mannheimia, Moraxella y Lactobacillus. Destacar que a nivel nasal representa el primer reporte de la abundancia y la diversidad de bacterias con potencial antimicrobiano, como son las bacterias acidolácticas. Pasando a la microbiota láctea o vaginal, en leche los principales géneros resultaron ser Streptococos, Estafilococos y Pseudomonas. Y en el caso de la vagina, los géneros con mayor abundancia fueron Histophilus, Ureaplasma y Escherichia-Shigella.
Se observó una vinculación de determinados géneros bacterianos con un grupo determinado de hembras del estudio. Por tanto, tomando que géneros bacterianos como Streptobacilos o Estafilococos, forman parte de una microbiota vaginal sana, según estudios previos metagenómicos, se observó con mayor abundancia en las hembras que habían tenido un parto normal. Por el contrario, en las hembras abortadas, se observaron otros genéros vinculados muchos de ellos a problemas reproductivos y de infertilidad en los pequeños rumiantes.
Por tanto, las principales conclusiones de esta parte del estudio es que se observaron por primera vez una disbiosis, unos cambios en la riqueza, en la composición microbiana a nivel vaginal tras un aborto en explotaciones donde se encuentra circulando Coxiella burnetii. Además, esta diferencia se observó al comparar hembras abortadas y no abortadas, pero es que también estas diferencias se pudieron observar intrarrebaño en una explotación donde el brote clínico había sido categorizado como leve. Por tanto, esto evidencia un impacto sobre la microbiota y, además, los resultados con la vinculación de agentes relacionados con infertilidad y problemas reproductivos, ya que se favorece el incremento de determinados patógenos. Estos resultados van en coherencia con estudios publicados previamente también por el grupo de investigación, donde se sabe que la riqueza, la uniformidad y la diversidad son especialmente menores en ovejas no gestantes. Por el contrario, una disbiosis vaginal es el enemigo del éxito reproductivo. A pesar de que en vacuno la infertilidad es la principal clínica que reportan los veterinarios por fiebre Q, en pequeños rumiantes queda mucho por investigar.
Respecto a la microbiota observada en los sementales, a nivel nasal también se observó la elevada abundancia de estas bacterias acidolácticas con potencial probiótico. Y, a nivel de la microbiota prepucial, destacan diversas especies que también eran más abundantes a nivel de la microbiota vaginal. Estos resultados van en coherencia con estudios previos que ya explican o evidencian una posible modulación de la microbiota reproductiva tras la monta, especialmente tras la monta natural, en el caso del ovino.
Por último, se detectó Coxiella burnetii tanto en muestras vaginales como en leche, independientemente de si eran abortadas o no abortadas, de ovino y caprino, así como muestras ambientales de comedero y de muestras de la cama, pero con una abundancia relativa menor al 1%. Aunque no fuera abundante, únicamente su presencia podría causar implicaciones en la microbiota, ya no solo a nivel global, sino también a nivel local, provocando en estos animales diferentes cursos de infección y de la enfermedad por desarrollar.
Conclusiones generales
- Es de vital importancia incluir a todos los animales del rebaño en los planes de control, vacunación y bioseguridad para conseguir el éxito en el control de esta zoonosis.
- La muestra nasal ha evidenciado una elevada sensibilidad diagnóstica en el ganado caprino, evidenciando un posible tropismo respiratorio infravalorado en rumiantes en general.
- Los comederos podrían ser un foco de infección y provocar, por la viabilidad de Coxiella burnetii y la resistencia ambiental, que los trabajos de control y bioseguridad no sean efectivos. Por lo tanto, deben incluirse en los planes de limpieza y desinfección.
- Es necesario combinar diversas herramientas diagnósticas para incrementar la sensibilidad diagnóstica, especialmente en rebaños donde la clínica no es tan evidente.
- La severidad del brote clínico por fiebre Q influye sobre el impacto de la microbiota global de ovejas y cabras afectadas.
- La disbiosis vaginal, así como el incremento de bacterias vinculadas a la infertilidad en las hembras abortadas, sugiere la necesidad de nuevos estudios que evalúen las consecuencias de la infección en aspectos como la fertilidad, producción de leche o a nivel respiratorio.

REVISTAS
Cabraespaña, noticias diarias sobre el mercado nacional e internacional del caprino, investigación ganadera, alimentación y sistemas de manejo.